Знаете ли вы, какой случай способствовал открытию антибиотиков?
Антибиотики (АБ) были открыты случайно. Александр Флеминг (британский микробиолог, лауреат Нобелевской премии по физиологии и медицине) оставил пробирку с бактериями стафилококка без внимания на несколько дней. Из-за обычного для его лаборатории беспорядка в пробирке выросла колония плесневых грибов и стала разрушать бактерии. Вследствие этого процесса Флемингу удалось выделить активное вещество — пенициллин [1].
Что происходит с чувствительностью бактерий к антибиотикам сейчас?
Много времени прошло после открытия антибиотиков. И их не всегда рациональное применение, а также циркуляция антибиотиков в природе и развитие защитных механизмов бактерий, привело к глобальной проблеме здравоохранения настоящего времени — антибиотикорезистентности (АБ-резистентности).
По словам Маргарет Чен, генерального директора ВОЗ, если в корне не пересмотреть отношение к антибиотикам, рано или поздно наступит постантибиотическая эпоха, в которой многие инфекции невозможно будет лечить.
Мнение ВОЗ о ситуации с антибиотиками в мире [2]
- В мире пока не разработаны крайне необходимые антибактериальные препараты, несмотря на растущее осознание серьезной и непосредственной угрозы устойчивости к антибиотикам;
- Почти все новые антибиотики, которые были выпущены в обращение в последние десятилетия, представляют собой разновидности классов антибиотиков, открытых еще до 1980-х годов;
- Ни один из 43 антибиотиков, находящихся в настоящее время на стадии клинической разработки, не решает в достаточной степени проблему устойчивости самых опасных в мире бактерий к лекарственным средствам.
С чем связаны причины развития антибиотикорезистентности?
Причины антибиотикорезистентности, которые не зависят от применения АБ в медицине [3]
-
Устойчивость к антибиотикам была распространена задолго до их использования:
- Многие бактерии несут гены резистентности для защиты от антибиотиков, продуцируемых грибами и другими бактериями;
- Гены АБ-резистентности найдены у микроорганизмов глубоко под землёй, во льдах и даже в вечной мерзлоте.
-
Фермы и сельское хозяйство являются главными источниками антибиотикорезистентных генов.
- Поэтому бывает так, что в организм человека попадают уже АБ-резистентные бактерии.
Причины антибиотикорезистентности, на которые влияет применение АБ в клинической практике [3]
Широкое (и не всегда обоснованное по дозировке или спектру действия) применение антибиотиков — важная причина приобретения бактериями резистентности к антибиотикам.
К антибиотикорезистентности приводит:
-
Вынужденное назначение АБ- терапии широкого спектра действия (без проведения бактериального посева);
-
Несоответствующий режим дозирования или несоблюдение полного курса антибиотикотерапии:
- Несоответствие выбранной дозы минимально подавляющей концентрации;
- Длительность курса применения антибиотиков меньше, чем прописано в инструкции и Клинических рекомендациях (средняя длительность терапии антибиотиками, за некоторыми исключениями, составляет не менее 7 дней при инфекционно-воспалительных заболеваниях (ИВЗ) в гинекологии);
-
Трудности проникновения антибиотика в очаг воспаления.

Механизмы резистентности к антибиотикам [4]
- Модификация антибиотика / детоксикация;
- Уменьшение проницаемости стенки бактерий для антибиотиков, образование биоплёнок;
- Выведение антибиотика из клетки (эффлюкс система) — выведение происходит быстрее, чем антибиотик поразит свои мишени;
- Структурные изменения в молекулах, являющихся мишенями для антибиотика;
- Продукция бактерией альтернативных мишеней, которые резистентны к ингибирующему действию антибиотика;
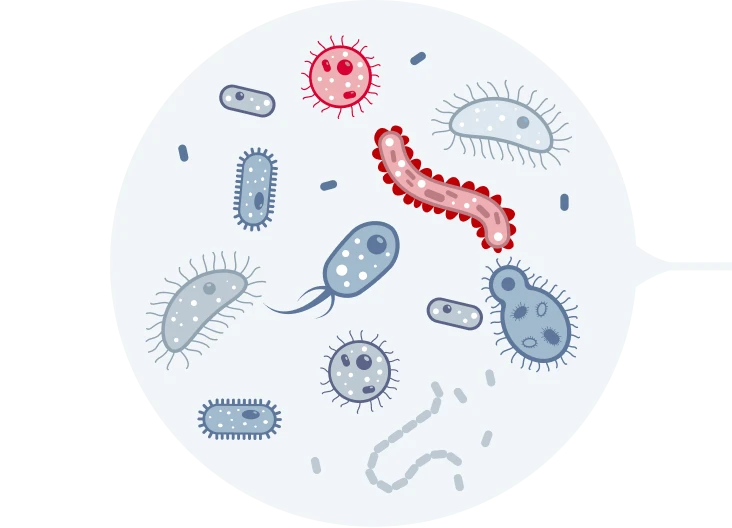
среди множества бактерий есть резистентные к АБ
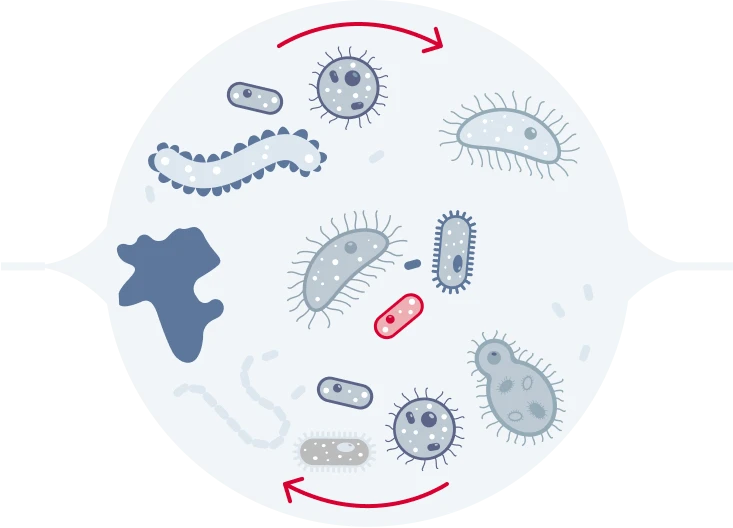
бактерии передают АБ-резистетность и формируют биопленки
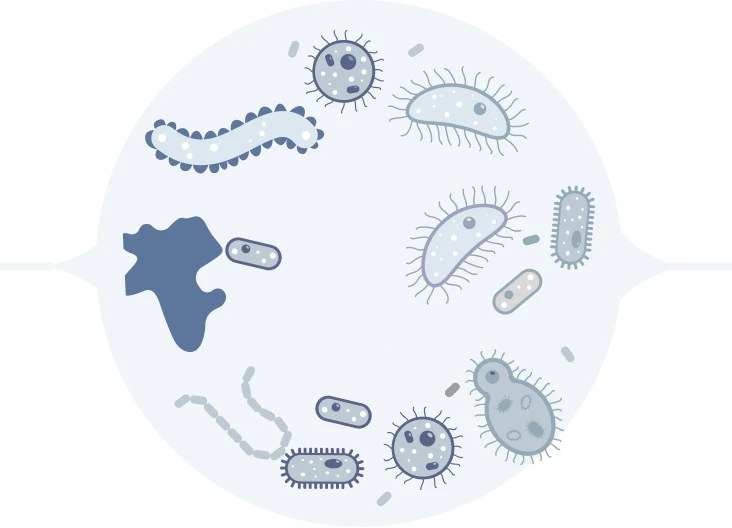
АБ влияет только на нерезистентную микрофору
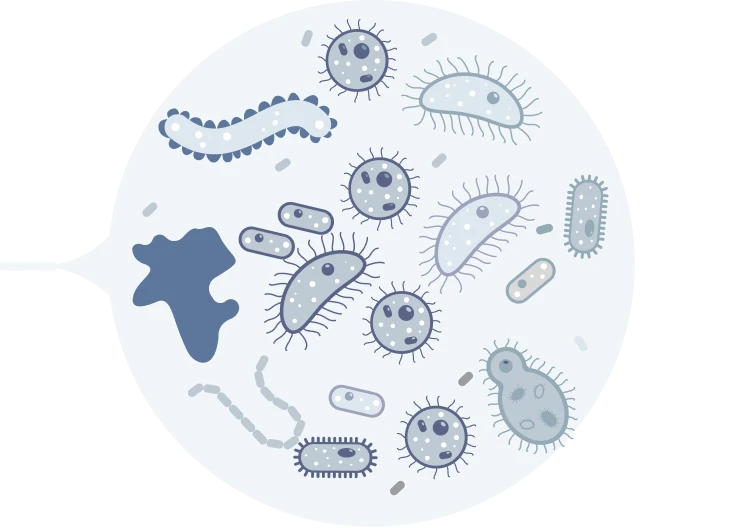
резистентные бактерии беспрепятственно размножаются
Как коронавирусная инфекция повлияла на АБ-резистентность [5]
Пандемия COVID—19 ещё больше усугубила проблему резистентности патогенов к антибактериальным средствам.
Из-за тяжести течения бактериальной пневмонии при COVID—19 врачи по всему миру активизировали назначение антибиотиков, причём часто без клинического и лабораторного обоснования. [5]
Но согласно клиническим рекомендациям по лечению COVID-19, назначение антибактериальных средств у пациентов с COVID—19 оправдано только при наличии убедительных признаков бактериальной инфекции. [5]
По результатам Российского опыта применения антибиотиков при COVID—19 (Исследование "Антибактериальная терапия пациентов с COVID—19 на амбулаторном и стационарном этапах") [5] установлено:
- Всем исследуемым пациентам (ретроспективно анализировали 160 карт пациентов, отобранных случайным образом) был назначен антибиотик;
- Однако, бактериальная инфекция была подтверждена только у одной пациентки;
- У остальных наличие бактериальной инфекции и её̈ возможный источник определены не были.
Таким образом, можно отметить, что не всегда обоснованное применение антибиотиков во время пандемии могло способствовать усугублению проблемы распространения антибиотикорезистентности.
Особенности применения антибиотиков в гинекологической практике и влияние на развитие АБ-резистентности
В гинекологии часто применяются местные интравагинальные формы антибактериальных (или комплексных антибактериальных и антимикотических) препаратов. Не стоит забывать, что для этиотропного лечения вагинитов с помощью интравагинальных форм оптимально делать посев на микрофлору и определять чувствительность. [6]

Ещё одна особенность терапии бактериальных инфекций в гинекологической практике заключается в том, что определить состав микрофлоры можно единственным способом — взяв мазок на бактериальный посев из цервикального канала, уретры и влагалища. Инфекционные поражения верхних отделов генитального тракта лечатся без возможности взятия биоптата или мазка. Состав микрофлоры может сильно отличаться от такового в нижних отделах мочеполовой системы. Зачастую практикующему гинекологу приходится проводить терапию исключительно эмпирическим путём, определить точный этиологический состав возбудителей не представляется возможным [7].
Вовремя не вылеченные воспалительные заболевания органов малого таза (ВЗОМТ) могут быть причиной хронического болевого синдрома, трубно-перитониального бесплодия и повышения риска эктопической беременности. [8]
Бесплодие часто является следствием хронического эндометрита, инфекционную составляющую которого трудно контролировать с помощью АБ-терапии в связи с АБ-резистентностью, которая усугубляется наличием персистирующей воспалительной реакции и формированием биопленок. [8]
Бактериальные плёнки: значительная роль в формировании любой инфекционной патологии
Термин «биоплёнка» (biofilm) был введён известным американским исследователем J. Costerton, положившим начало интенсивным исследованиям этого феномена [9]. Многие хронические инфекции обусловлены бактериями, которые способны образовывать биоплёнки [10, 11]. Согласно современным представлениям, биоплёнка — это структурно организованное сообщество микроорганизмов, заключённое внутри полимерного матрикса, синтезированного членами сообщества.
Характерные черты для биоплёнок [17]:
- Структурная гетерогенность;
- Генетическое разнообразие (биоплёнку могут формировать представители разных видов микроорганизмов, включая бактерии, простейшие, мицелий грибов);
- Сложные регуляторные механизмы, контролирующие «общественные взаимоотношения» внутри сообщества микроорганизмов в биоплёнке;
- Наличие внеклеточного экзополимерного матрикса.
Матрикс биопленки защищает микроорганизмы от факторов внешнего воздействия, будь то факторы внешней среды или факторы иммунной защиты организма. Свойства бактерий внутри сообщества значительно отличаются от таковых у изолированных клеток [17].
Бактериальные плёнки: значительная роль в формировании любой инфекционной патологии [18]
Вопрос терапии инфекционно-воспалительных заболеваний, связанных с образованием биопленок, очень остро стоит в ежедневной практике у гинеколога и требует применения дополнительной терапии, которая назначается в поддержку антибиотиков.
Как распространяются гены антибиотикорезистентности [12]
Гены устойчивости к антибиотикам могут передаваться через плазмиды (небольшие молекулы ДНК, физически обособленные от хромосом и способные к автономной репликации). Таким образом, бактериальные клетки, которые раньше были чувствительны к антибиотикам, после передачи генетической информации через плазмиды могут стать резистентными.
Как происходит передача резистентности к антибиотикам через плазмиды
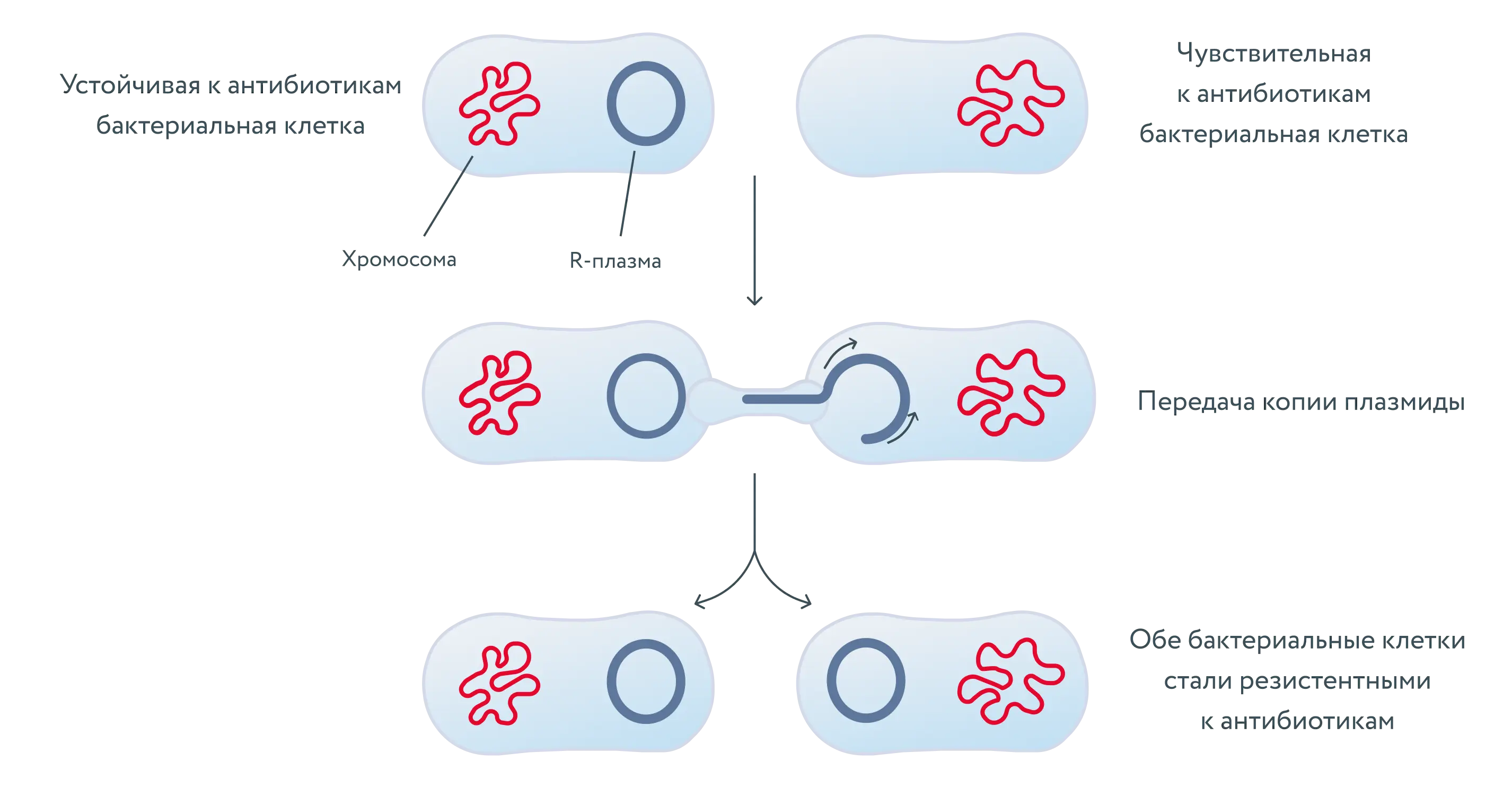
Пути преодоления антибиотикорезистентности
Влияние на биоплёнки и передачу генов устойчивости с помощью экзогенных протеолитических ферментов
Известно, что биопленка является идеальной нишей для обмена генетической информацией между бактериями. В исследовании Тец В.В. и соавторов [12, 13] изучалась особенность действия экзогенных ферментов на микробные сообщества и выживаемость бактерий в биопленках в присутствии антибиотиков.
Кратко об исследовании Тец В.В. и соавторов:
— В работе использованы: ампициллин, гентамицин, линкомицин, цефотаксим, ципрофлоксацин, тетрациклин, рифампицин, канамицин, хлорамфеникол, нистатин.
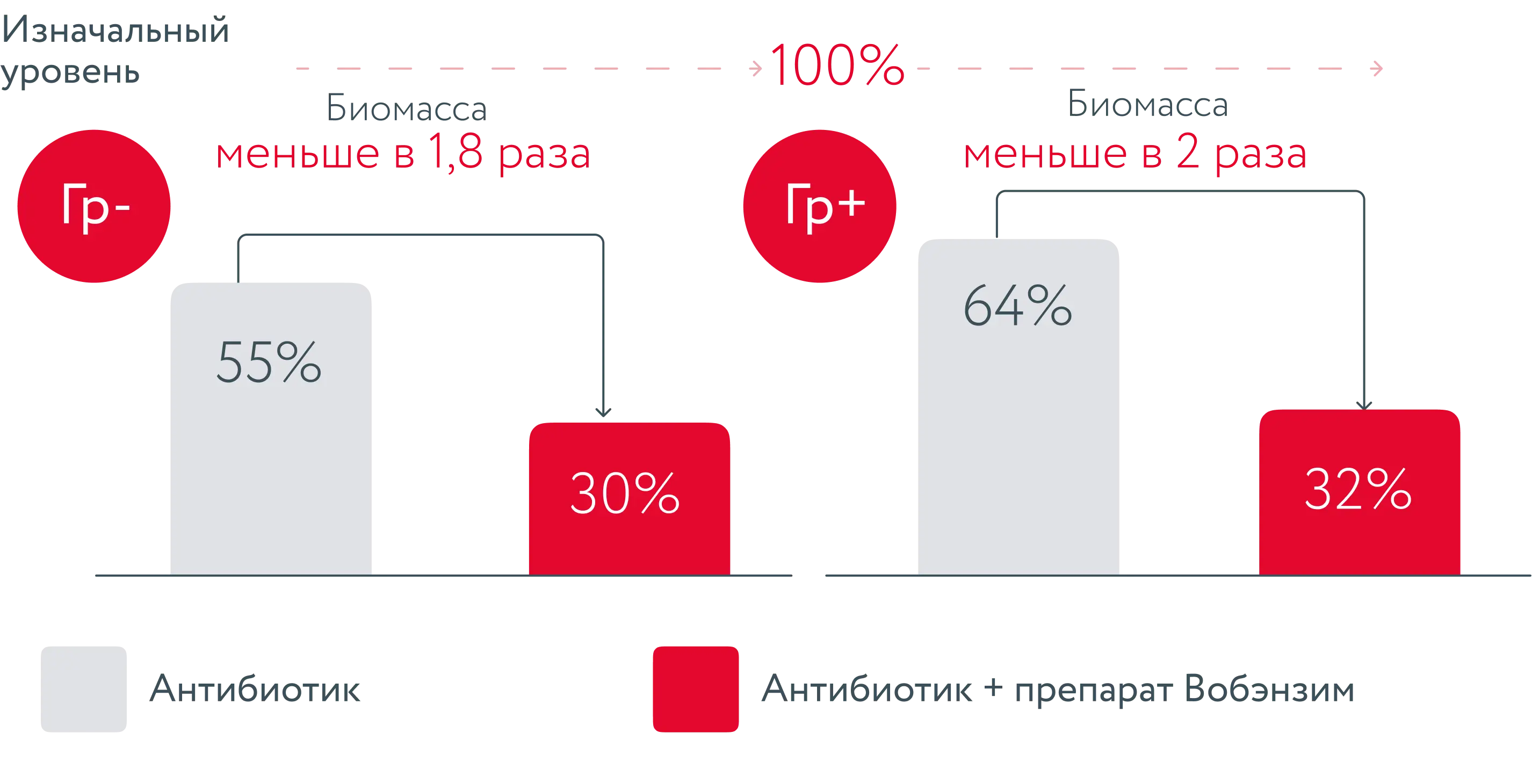
Результаты исследования показали, что препарат Вобэнзим угнетает формирование микробных колоний (биоплёнок) и повышает доступность для проникновения антибиотиков в смешанные микробные сообщества у Гр (-) и Гр (+) бактерий.
Биомасса бактериальной биоплёнки, %
При изучении влияния препарата на способность передачи генов антибиотикорезистентности удалось установить, что препарат Вобэнзим снижает частоту передачи плазмидных генов антибиотикоустойчивости в бактериальных биоплёнках в 2 раза за 1 день и в 3 раза за 7 дней.
Число рекомбинантов генов антибиотикорезистентности E.coli, устойчивой к ампициллину/тетрациклину
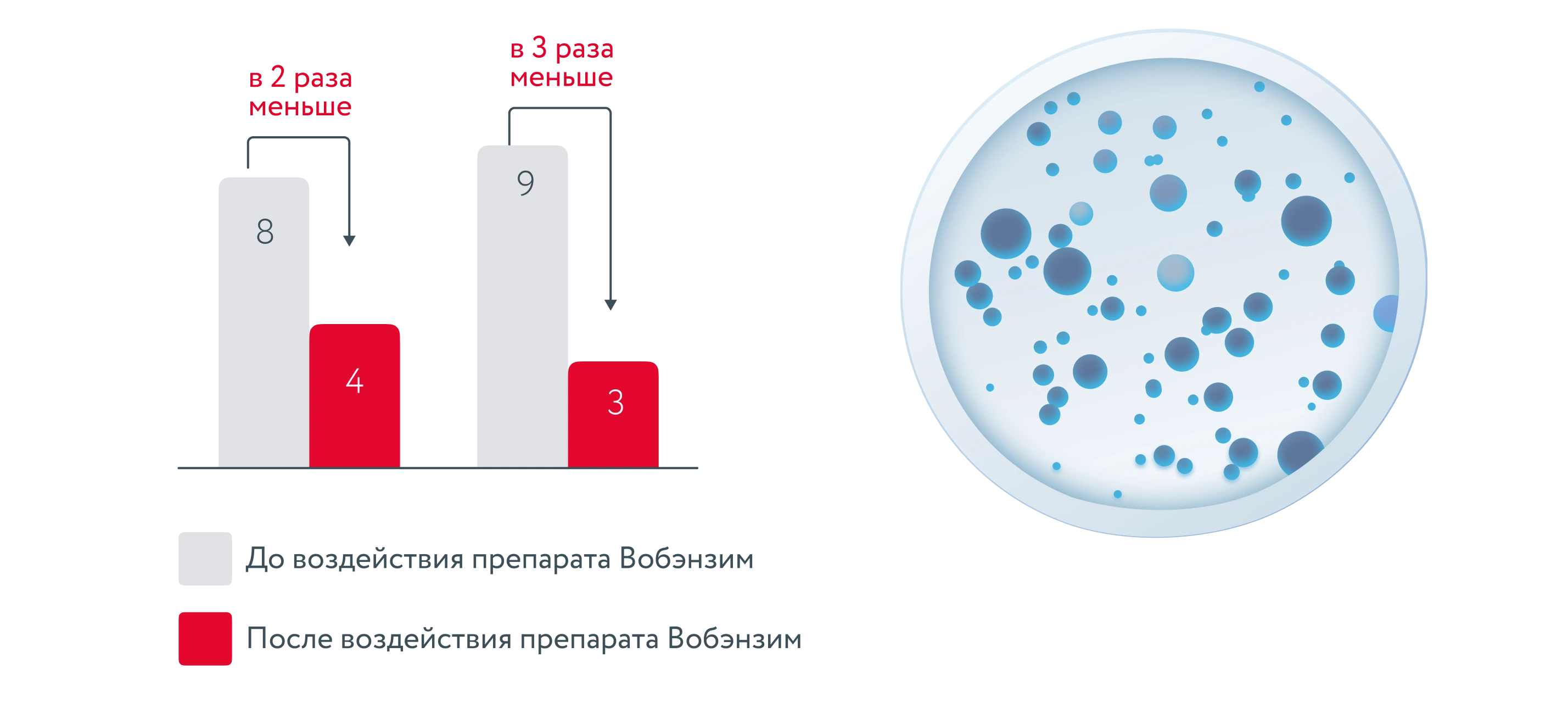
Кроме того, при действии ферментов, входящих в состав препарата Вобэнзим, зарегистрировано уменьшение количества внеклеточного матрикса, что очевидно снижает эффективность передачи генов между бактериями биоплёнок.
Полученные данные свидетельствуют о возможности влиять с помощью экзогенных ферментов на частоту передачи плазмидных генов АБ-устойчивости в бактериальных плёнках, что способствует снижению риска развития резистентности к антибиотикам и повышает эффективность антибактериальной терапии.
Увеличение концентрации антибиотика в очаге воспаления в присутствии системной энзимотерапии
В исследовании профессора Ткачук В.Н. и соавторов [14] в течение 10 лет проводилось изучение ближайших и отдалённых результатов лечения пациентов с хроническим бактериальным простатитом антибиотиками в комбинации с препаратом системной энзимотерапии — препаратом Вобэнзим.
Кратко о дизайне исследования Ткачук В.Н. и соавторов.
Изучение результатов лечения больных хроническим бактериальным простатитом лекарственным средством системной энзимотерапии — препаратом Вобэнзим.
— Группа сравнения (40 человек) — только стандартная АБ-терапия.
Применение препарата Вобэнзим позволило у большинства пациентов (96,2%) добиться элиминации возбудителя заболевания за счёт более высокой концентрации антибактериального препарата в очаге воспаления, а также существенно снизить длительность и интенсивность симптомов.
Комплексная АБ-терапия с препаратом Вобэнзим увеличивет концентрацию антибиотика в очаге воспаления на 50%, что в 1,7 раза превышает элиминацию возбудителя.
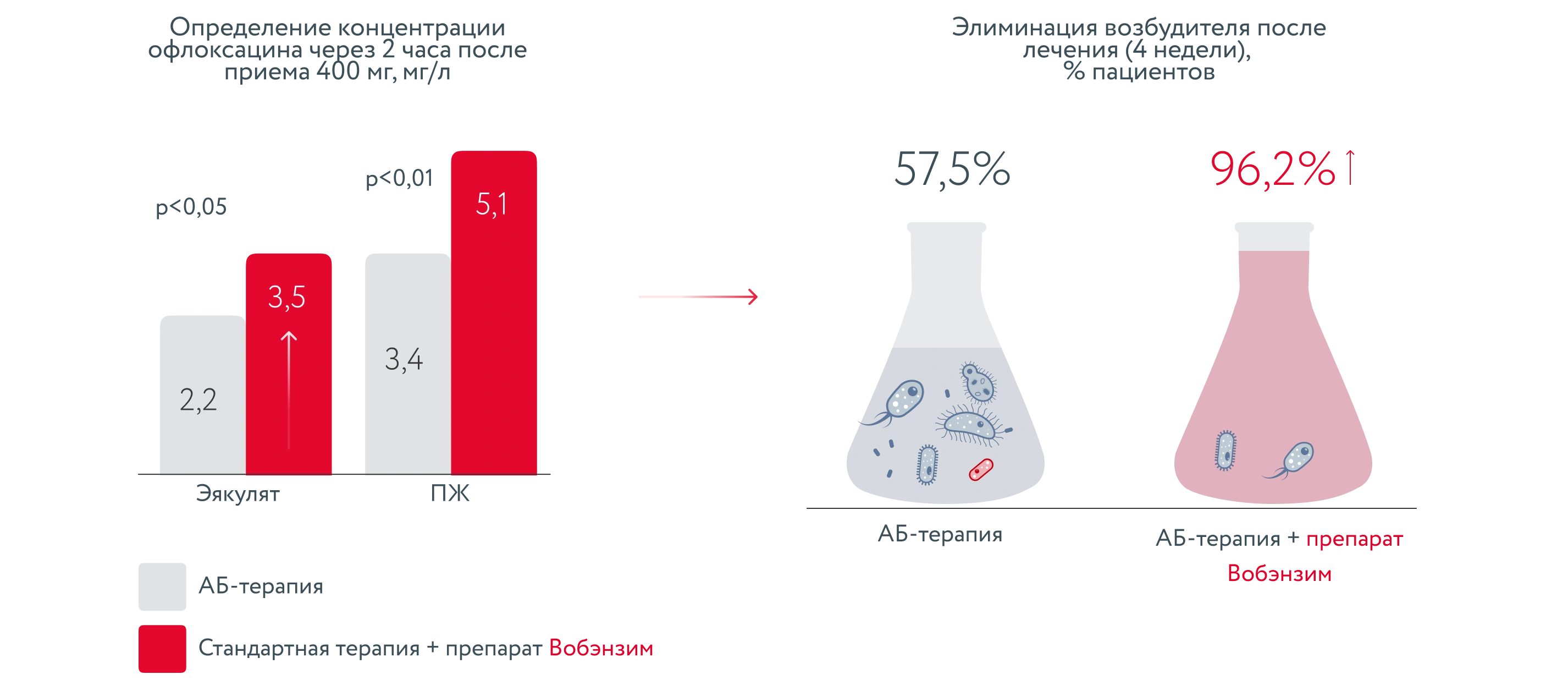
Несмотря на то что данное исследование проведено с участием пациентов с хроническим бактериальным простатитом, оно имеет неоценимую значимость и для гинекологической практики. В работе показаны результаты по оценке концентрации антибиотиков и элиминации возбудителя из «живой ткани», а не «в пробирке».
Описать причину повышения концентрация АБ в очаге воспаления в присутствии препарата Вобэнзим можно следующим образом [15]:
-
Противовоспалительное действие:
- уменьшение инфильтрации интерстиция плазматическими клетками;
- повышение элиминации белкового детрита и депозитов фибрина в зоне воспаления, ускорение лизиса токсических продуктов обмена веществ и некротизированных тканей;
- Улучшение микроциркуляции и реологических свойств крови [15];
- улучшение перфузии антибиотиков в повреждённые ткани и микробные сообщества. [15]
Заключение
Сочетанное применение препарата Вобэнзим и антибактериальных препаратов позволяет снизить проявления антибиотикорезистентности [12, 13]:
- трудности проникновения антибиотиков в очаг воспаления;
- устойчивость патогенов из-за включения их в биопленки;
- передача плазмидных генов устойчивости к антибиотикам.
2 декабря 2022 г. в Москве под эгидой Национальной ассоциации акушеров-гинекологов и репродуктологов «Женское здоровье» состоялся Совет Экспертов, посвящённый перспективным направлениям использования препарата Вобэнзим в гинекологии. В совете экспертов приняли участие ведущие специалисты из многих регионов РФ.
Чтобы ознакомиться с резолюцией Совета экспертов, перейдите по ссылке ниже. [16]
Ознакомиться с резолюциейВ опубликованной резолюции [16] указано, что препарат Вобэнзим — патогенетически обоснованный компонент терапии инфекционно-воспалительных заболеваний, а также даны рекомендации по его применению.
Эксперты отмечают, что препарат Вобэнзим не только позволяет преодолевать антибиотикорезистентность, уменьшает длительность и выраженность cимптомов ИВЗ, но и предотвращает рецидивы и чрезмерный спаечный процесс при терапии инфекционно-воспалительных заболеваний.
Источники
- https://ru.wikipedia.org/ Доступ от 18.10.23
- WHO. Global Action Plan on AntimicrobialResistance.(InRuss). https://www.who.int/antimicrobial-resistance/publica tions/global-action-plan/ru
- Ручко Е.Н., Плешакова В.И. Гены антибиотикорезистентности как проблема XXI века. Фундаментальные и прикладные исследования по приоритетным направлениям биоэкологии и биотехнологии. 2022. С. 90
- Галяутдинова Ю.А. ГЕНЫ РЕЗИСТЕНТНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ. Форум молодых учёных. 2018. № 12–2 (28)
- https://pharmznanie.ru/ Доступ от 18.10.23
- И.В. Кузнецова. Трудности терапии аэробного вагинита и пути их преодоления. Медицинский алфавит № 10/2017, том № 2 Современная гинекология, с. 23
- Бебнева Т.Н., Дамиров К.Ф. Воспалительные заболевания органов малого таза. Гинекология. 2019; 21 (5): 39–44
- Goje O, Markwei M, Kollikonda S, et al: Outcomes of minimally invasive management of tubo-ovarian abscess: A systematic review. J Minim Invasive Gynecol 28 (3):556—564, 2021
- Costerton JW, Cheng KJ, Greesey GG. Bacterial biofilms in nature and disease. Annu Rev Microbiol. 1987; 41:435–464
- Jamal M, Ahmad W, Andleeb S, Jalil F, Imran M, Nawaz MA, et al. Bacterial biofilm and associated infections. J Chin Med Assoc. 2018; 81:7–11
- Hall MR, Mc Gillicuddi E, Kaplan LJ. Biofilm: basic principles, pathophysiology, and implications for clinicians. Surg Infect (Larchmt.). 2014; 15(1):1—7
- Тэц В.В. и др. Влияние экзогенных протеолитических ферментов на бактерии. Антибиотики и химиотерапия. 2004
- Тец В.В. и др. Влияние экзогенных протеолитических ферментов на передачу плазмидных генов в смешенных бактериальных плёнках. Антибиотики и химиотерапия. 2009
- Ткачук В.Н., Аль-Шукри А. С. И др. Результаты 10-летнего исследования эффективности протеолитических энзимов у больных хроническим простатитом. Урологические ведомости. 2015. № 2
- Инструкция по медицинскому применению препарата Вобэнзим, ЛП-№ (002667)-(РГ-RU) от 30.06.2023
- Доброхотова Ю.Э., Хрянин А.А., Ших Е.В. и др. Совет Экспертов: перспективные направления системной энзимотерапии в гинекологии. РМЖ. Мать и дитя. 2023; 6(*):1—8
- Ильина Т.С., Романова Ю.М. Бактериальные биопленки: роль в хронических инфекционных процессах и поиск средств борьбы с ними. Молекулярная генетика, микробиология и вирусология. 2021;39(2):14‑24
- Глушанова Н.А., Блинов А.И. и др. Бактериальные биопленки в инфекционной патологии человека // Мв К. 2015. № Спецвыпуск 2.











