История изучения биоплёнок
Исторически исследователи в ходе своих экспериментов рассматривали бактерии в качестве одноклеточных планктонных организмов, которые за пределами лаборатории в большинстве своём живут преимущественно в организованных многоклеточных сообществах — биоплёнках [2].
В дальнейшем медицинское сообщество начало уделять внимание биоплёнкам, образованным на твёрдых поверхностях, например на медицинских изделиях (урологических катетерах, имплантах суставов, клапанах сердца, операционных материалах). Теперь известно, что биоплёнки также образуются на различных слизистых оболочках и тканях [1].
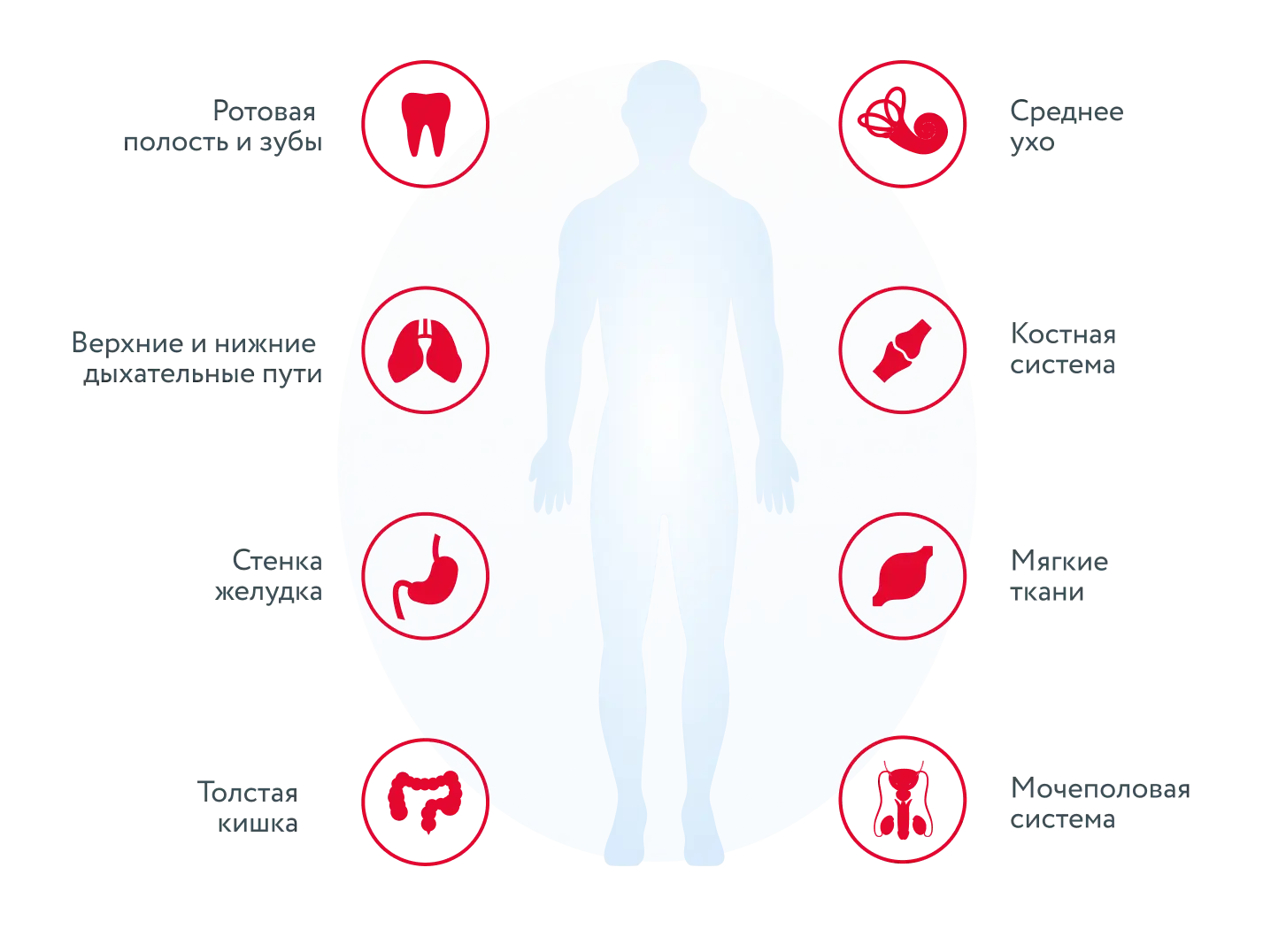
За последние несколько десятилетий образцы, содержащие биоплёнки, были получены из многочисленных локализаций, в том числе из мочеполовой системы, среднего уха, верхних дыхательных путей, ротовой полости, сердечно-сосудистой системы, лёгких, желудка, толстой кишки, костей и из ран мягких тканей [3] (рисунок 1).
Бактериальные и смешанные (которые в своём составе содержат как бактерии, так и, например, мицелий грибов) биоплёнки — одна из проблем современности в терапии инфекционно-воспалительных заболеваний, в том числе в гинекологии.

Инфекционные процессы, вызванные пленкообразующими штаммами
Образование бактериальных биоплёнок может привести к хронизации воспалительных и прогрессированию аутоиммунных заболеваний в организме [1].
Наиболее распространёнными инфекциями, связанными с образованием биоплёнок, являются инфекции мочевыводящих путей [5].
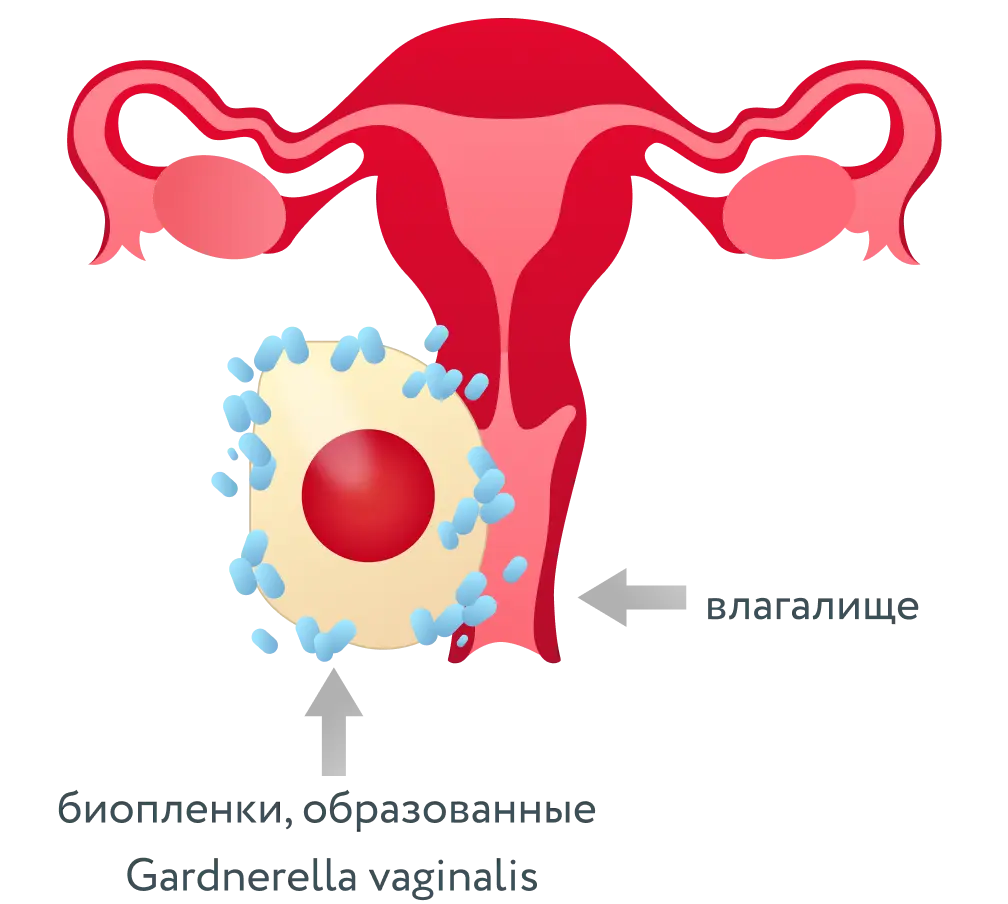
До настоящего времени исследователи были сосредоточены на изучении биоплёнок, образованных бактериями одного вида. Но теперь микробиологи уделяют больше внимания биоплёнкам, состоящим из представителей разных таксономических групп, и взаимодействию клеток внутри бактериальных сообществ [1]. Смешанные биоплёнки могут включать не только бактерии, но также мицелии грибов и простейшие.
Установлено, что биоплёнки демонстрируют
следующие характеристики [8]
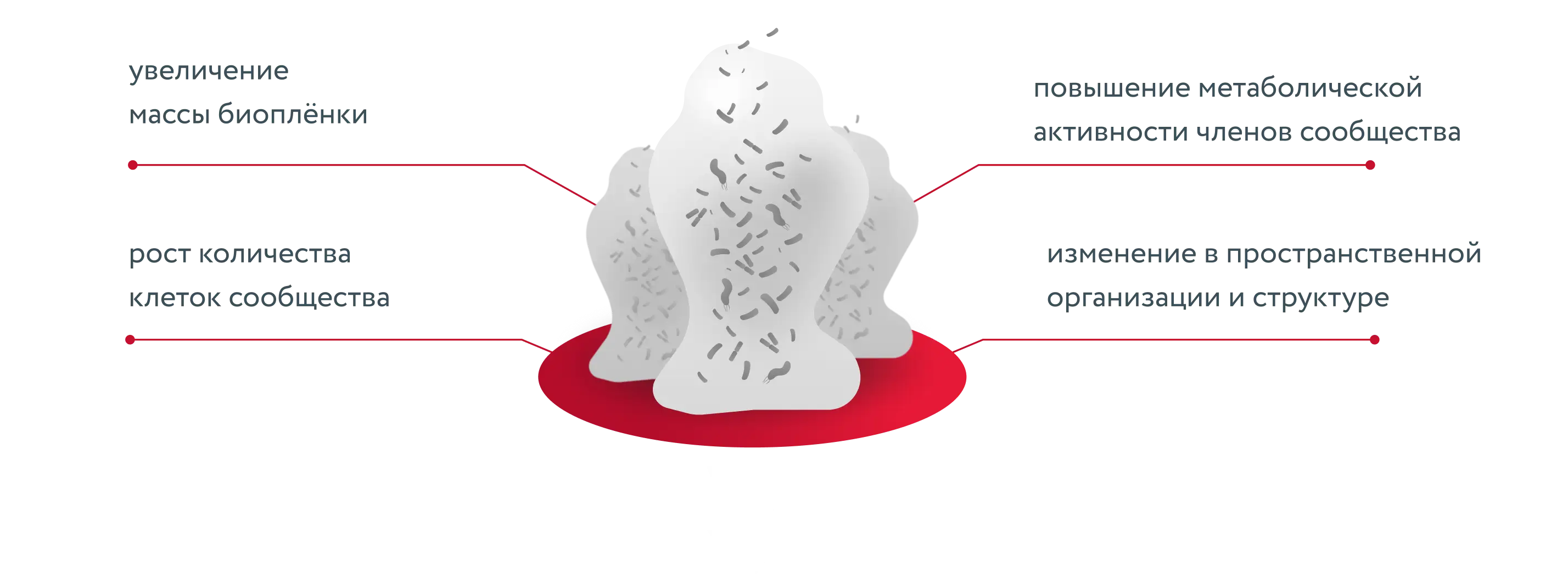
В результате биоплёнки приводят к повышению устойчивости к противомикробным препаратам [8]

Как образуются биоплёнки?
Из-за видового разнообразия стадии формирования биоплёнок могут различаться. Но в целом образование бактериальных биоплёнок представляет собой многоступенчатый процесс: (рисунок 2).
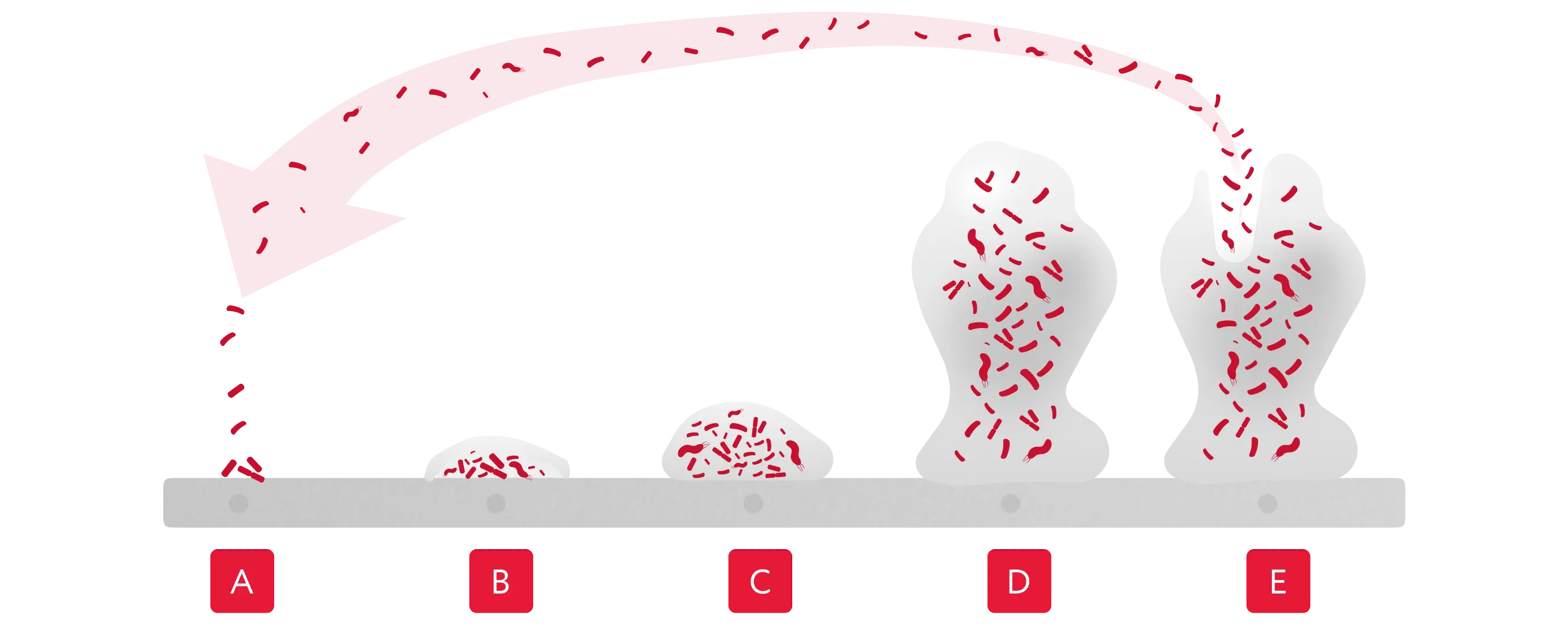
- — Обратимое прикрепление бактерий к поверхности (например, к слизистой оболочке).
- — Необратимое прикрепление бактерий.
- — Образование новых бактериальных клеток и секреция внеклеточного полимерного матрикса (ВПМ).
- — Созревание биоплёнки путём наращивания биологической массы и размножения бактерий.
- — Отделение от зрелой биоплёнки бактериальных клеток, их перемещение на новую локализацию и повторение стадий образования биоплёнки[9].
Биоплёнки обычно определяются как фиксированные микробные сообщества, заключённые во внеклеточном полимерном матриксе (ВПМ). Биоплёнка имеет структуру каналов, которая контролирует выделение газов, питательных веществ. Около 90% массы биоплёнки состоит из матрикса [10], который, в свою очередь, состоит из внеклеточных полисахаридов, экзогенной ДНК, белков и липидов [11, 12].
Антибиотикорезистентность — свойство микроорганизма или биоплёнки?
Одним из широко распространённых последствий образования биоплёнок во время инфекционно-воспалительных процессов является снижение эффективности лечения антибиотиками, что может замедлить элиминацию патогенов и привести к хронизации заболевания. Даже очень маленькие, активно растущие плёнкоподобные скопления бактерий, содержащие всего 150 клеток, могут проявлять пониженную чувствительность к антибиотикам по сравнению с клетками, растущими при более низкой плотности биоплёнок [13].

Помимо повышения выживаемости бактерий во время лечения антибиотиками, биоплёнки способны обеспечивать защиту от клеточных и гуморальных факторов, реализуемых в ходе иммунного ответа организма на инфекционный агент. В матрикс биоплёнки могут быть интегрированы компоненты макроорганизма, такие как иммуннокомпетентные клетки, фибрин, иммуноглобулины или тромбоциты [14, 15].
Важно обратить внимание, что способность к плёнкообразованию не связана напрямую с антибиотикорезистентностью микроорганизмов. Способностью к образованию биоплёнок обладают как антибиотикорезистентные штаммы, так и чувствительные к препаратам изоляты [16].
Устойчивость к противомикробным препаратам в некоторых случаях обусловлена наличием внеклеточного матрикса, что делает использование этиотропной терапии мало эффективным даже в отношении чувствительных штаммов. Устойчивость бактериальных изолятов в биоплёнках обусловлена в первую очередь ограниченной диффузией антибактериальных препаратов через биоплёнки, а также активацией специфических механизмов защиты [17].

Способы борьбы с биоплёнками
Хотя биоплёнки достаточно хорошо изучены, до сих пор не разработаны чёткие алгоритмы по профилактике биоплёнкообразования у условно-патогенных микроорганизмов и успешной эрадикации возбудителей, образующих биоплёнки [1].
Ингибирование образования или деструкция существующих бактериальных плёнок
- ионизирующее излучение
- ультрафиолетовое излучение
- ультразвуковая обработка [1]
- применение бактериофагов
- ферментативные методы, которые являются относительно новыми методами борьбы с биоплёнками и обладают более высокой, по сравнению с указанными ранее методами, эффективностью ингибирования плёнкообразующей способности [1]
- универсальностью для борьбы с биоплёнками, образованными различными микроорганизмами;
- возможностью ограничивать накопление внеклеточного матрикса;
- способностью вмешиваться в механизмы коммуникации между клетками биоплёнки;
- синергетическим действием с антибактериальными средствами [20].
Среди биологических методов ингибирования предпочтение отдаётся ферментам [1, 21]. Ферменты участвуют в процессах образования внеклеточного матрикса, межклеточной коммуникации, созревании и распространении биоплёнок.

- оксидазы [23]
- ферментов, расщепляющих полисахариды [24]
- протеолитических ферментов [25]
- липазы [26]
- сериновых и цистеиновых протеаз [27]
Влияние препарата Вобэнзим на биоплёнки
Препарат Вобэнзим как системный полиферментный препарат представляет интерес для исследователей и врачей в реальной клинической практике в качестве дополнительной терапии, способствующей эффективной борьбе с инфекциями, вызванными плёнкообразующими микроорганизмами.
В состав
препарата Вобэнзим входит комбинация энзимов натурального происхождения [28]:

Поступая в организм, энзимы всасываются в тонкой кишке путём резорбции интактных молекул и, связываясь с транспортными белками крови, попадают в кровоток. В дальнейшем энзимы мигрируют по сосудистому руслу и накапливаются в зоне патологического процесса [28].
- Показано, что внеклеточный матрикс бактериальных биоплёнок содержит внеклеточную ДНК, несущую маркеры антибиотикоустойчивости.
- Изучено действие комплекса ферментов препарата Вобэнзим на передачу плазмидных генов в биоплёнках грамотрицательных бактерий.
- Установлено, что воздействие комплекса ферментов препарата Вобэнзим приводит к снижению частоты (в 2 раза) передачи генов антибиотикочувствительности в смешанных бактериальных биоплёнках.
В 2024 году были опубликованы результаты проведённого исследования по изучению активности препарата Вобэнзим на биоплёнках штаммов бактерий, выделенных от пациентов отделений перинатального центра.
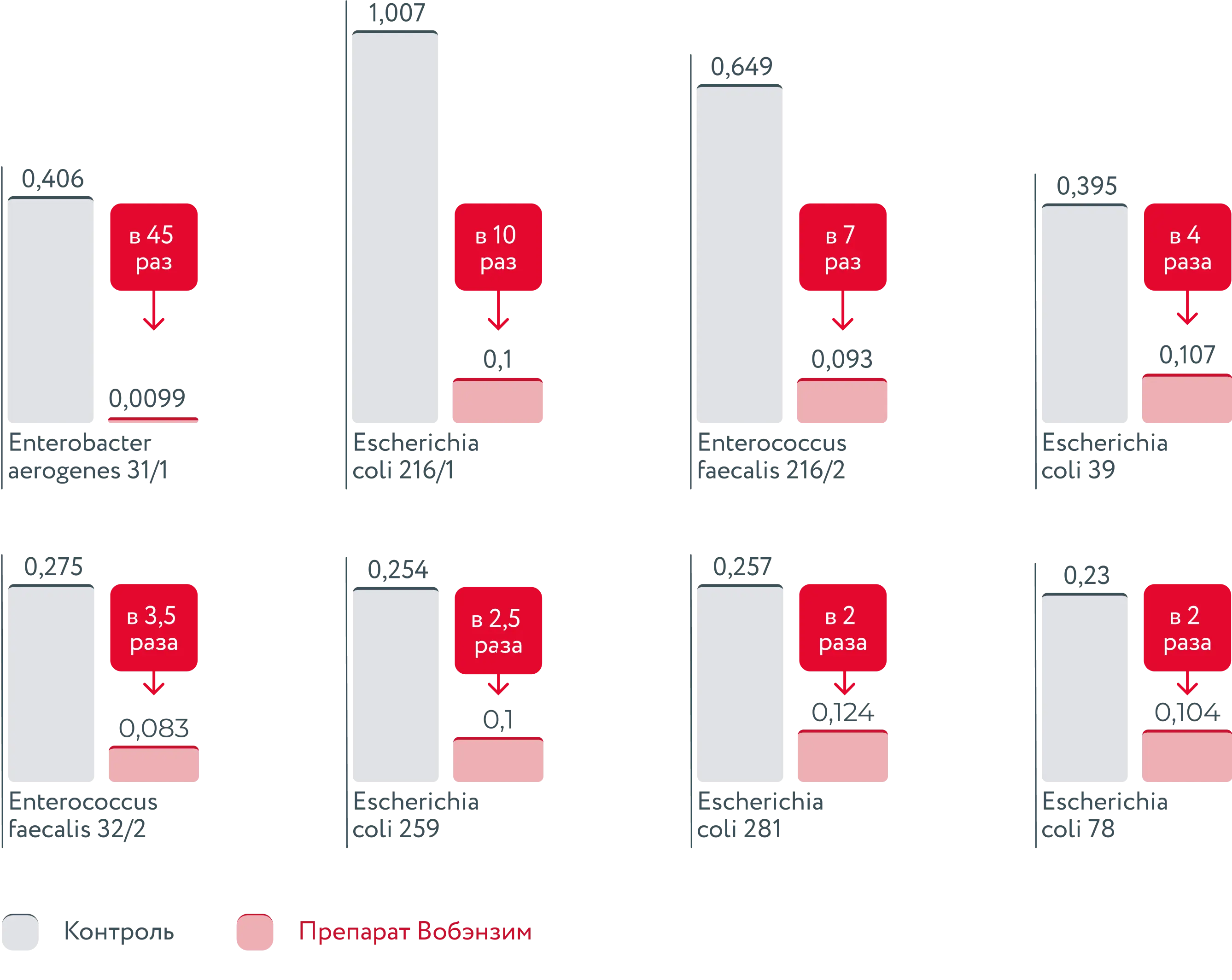
Результаты исследования влияния ферментного препарата Вобэнзим на процесс формирования биоплёнок штаммов бактерий [30]:
Препарат Вобэнзим разрушает бактериальные плёнки и снижает их биомассу до 45 раз [30]

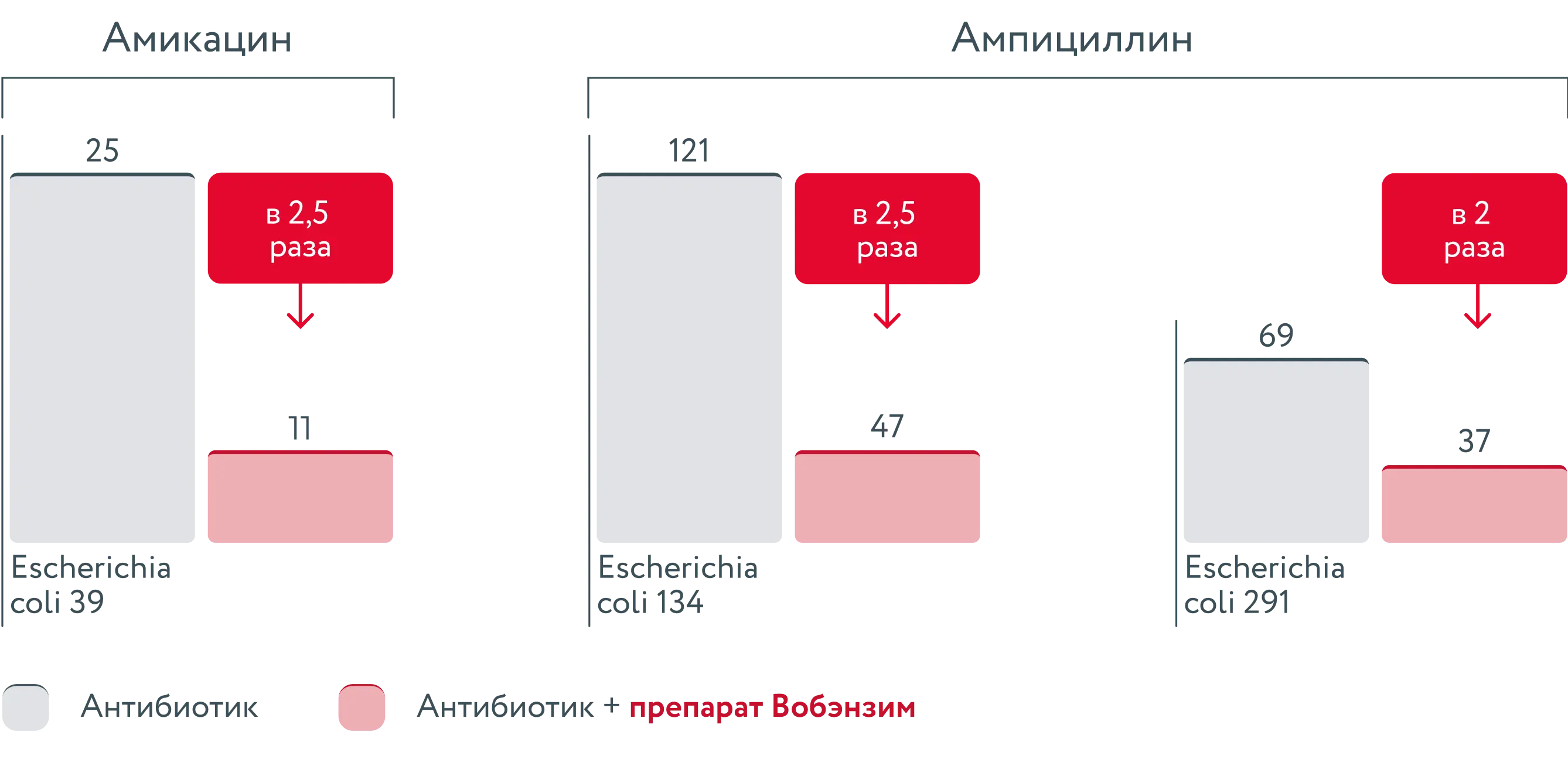
Число КОЕ после культивирования штаммов E.Coli в присутствии амикацина, ампициллина [30]
Препарат Вобэнзим содержит комплекс протеолитических ферментов (сериновые протеазы — трипсин и химотрипсин, цистеиновые протеазы — папаин и бромелаин), комплекс, разрушающий полисахариды (амилаза), липолитические ферменты (липаза) и панкреатин [28]. Это определяет воздействие на несколько компонентов биоплёнки и объясняет универсальность действия препарата Вобэнзим на плёнки, образованные разными штаммами.
Согласно результатам исследования, комплекс энзимов, входящих в состав препарата Вобэнзим, оказывает in vitro разрушающее действие на биоплёнки, сформированные микроорганизмами — возможными возбудителями вагинальных инфекций, — такими как: E. coli, K. pneumoniae, E. faecalis и E. aerogenes [30].

Совместное применение препарата Вобэнзим с антибактериальной терапией может использоваться для повышения клинической эффективности терапии по двум механизмам:
- За счёт снижения плёнкообразующей способности микроорганизмов.
- За счёт повышения эффективности антибактериальных препаратов [30].
Источники
- Zhao A, Sun J, Liu Y. Understanding bacterial biofilms: From definition to treatment strategies. Front Cell Infect Microbiol. 2023 Apr 6;13:1137947.
- Flemming H.-C., Wuertz S. (2019). Bacteria and archaea on Earth and their abundance in biofilms. Nat. Rev. Microbiol. 17, 247–260.
- Perry EK, Tan MW. Bacterial biofilms in the human body: prevalence and impacts on health and disease. Front Cell Infect Microbiol. 2023 Aug 30;13:1237164.
- Fleming, D., Rumbaugh, K. P. (2017). Approaches to dispersing medical biofilms. Microorganisms 5 (2), 15.
- Mirzaei R., Mohammadzadeh R., Alikhani M.Y., Shokri Moghadam M., Karampoor S., Kazemi S., Barfipoursalar A., Yousefimashouf R. The biofilm-associated bacterial infections unrelated to indwelling devices. IUBMB Life. 2020 Jul; 72 (7): 1271–1285.
- Castro, J., Alves, P., Sousa, C., Cereija, T., França, Â., Jefferson, K. K., et al. (2015). Using an in-vitro biofilm model to assess the virulence potential of bacterial vaginosis or non-bacterial vaginosis gardnerella vaginalis isolates. Sci. Rep. 5, 11640.
- Gaspar, C., Rolo, J., Cerca, N., Palmeira-de-Oliveira, R., Martinez-de-Oliveira, J., Palmeira-de-Oliveira, A. (2021). Dequalinium chloride effectively disrupts bacterial vaginosis (BV) Gardnerella spp. biofilms. Pathogens 10 (3), 261.
- Sadiq, F. A., Burmølle, M., Heyndrickx, M., Flint, S., Lu, W., Chen, W., et al. (2021). Community-wide changes reflecting bacterial interspecific interactions in multispecies biofilms. Crit. Rev. Microbiol. 47 (3), 338–358.
- Kranjec, C., Morales Angeles, D., Torrissen Mårli, M., Fernández, L., García, P., Kjos, M., et al. (2021). Staphylococcal biofilms: Challenges and novel therapeutic perspectives. Antibiotics (Basel) 10 (2), 1311.
- Costerton J. W. (1999). Introduction to Biofilm. Int. J. Antimicrob. Agents 11, 217–221.
- Schilcher, K., Horswill, A. R. (2020). Staphylococcal biofilm development: Structure, regulation, and treatment strategies. Microbiol. Mol. Biol. Rev. 84 (3), e00026—e00019.
- Chiba, A., Seki, M., Suzuki, Y., Kinjo, Y., Mizunoe, Y., Sugimoto, S. (2022). Staphylococcus aureus utilizes environmental RNA as a building material in specific polysaccharide-dependent biofilms. NPJ Biofilms Microbiomes 8 (1), 17.
- Connell J. L., Wessel A. K., Parsek M. R., Ellington A. D., Whiteley M., Shear J. B. (2010). Probing prokaryotic social behaviors with bacterial «Lobster traps». mBio 1, e00202—e00210.
- Thurlow L. R., Hanke M. L., Fritz T., Angle A., Aldrich A., Williams S. H., et al. (2011). Staphylococcus aureus biofilms prevent macrophage phagocytosis and attenuate inflammation in Vivo . J. Immunol. 186, 6585–6596.
- Шалепо К.В., Михайленко Т.Г., Савичева А.М. Роль бактериальных пленок в формировании хронических патологических процессов во влагалище и эндометрии // Журнал акушерства и женских болезней. — 2016. — Т. 65. — № 4. — C. 65-75.
- Giedraitiene A., Pereckaite L., Bredelyte-Gruodiene E., Virgailis M., Ciapiene I., Tatarunas V. CTX-M-producing Escherichia coli strains: resistance to temocillin, fosfomycin, nitrofurantoin and biofilm formation. Future Microbiol. 2022 Jul; 17: 789–802.
- Ciofu O., Tolker-Nielsen T. Antibiotic tolerance and resistance in biofilms. In: T. Bjarnsholt, P. Jensen, C. Moser, N. Høiby (eds.). Biofilm Infections. Springer, New York, NY. 2010.
- Хрянин А. А. Биоплёнки микроорганизмов: современные представления //Антибиотики и химиотерапия. — 2020. — Т. 65. — №. 5-6. — С. 70-77.
- Galié, S., García-Gutiérrez, C., Miguélez, E. M., Villar, C. J., Lombó, F. (2018). Biofilms in the food industry: Health aspects and control methods. Front. Microbiol. 9.
- Wiens, J. R., Vasil, A. I., Schurr, M. J., Vasil, M. L. (2014). Iron-regulated expression of alginate production, mucoid phenotype, and biofilm formation by Pseudomonas aeruginosa. mBio 5 (1), e01010—e01013.
- Tan, Y., Ma, S., Leonhard, M., Moser, D., Ludwig, R., Schneider-Stickler, B. (2020). Co-Immobilization of cellobiose dehydrogenase and deoxyribonuclease I on chitosan nanoparticles against fungal/bacterial polymicrobial biofilms targeting both biofilm matrix and microorganisms. Mater Sci. Eng. C Mater Biol. Appl. 108, 110499.
- Ivanova, K., Fernandes, M. M., Francesko, A., Mendoza, E., Guezguez, J., Burnet, M., et al. (2015). Quorum-quenching and matrix-degrading enzymes in multilayer coatings synergistically prevent bacterial biofilm formation on urinary catheters. ACS Appl. Mater Interfaces 7 (49), 27066–27077.
- Nguyen, U. T., Burrows, L. L. (2014). DNase I and proteinase K impair listeria monocytogenes biofilm formation and induce dispersal of pre-existing biofilms. Int. J. Food Microbiol. 187, 26–32.
- Saggu, S. K., Jha, G., Mishra, P. C. (2019). Enzymatic degradation of biofilm by metalloprotease from microbacterium sp. SKS10. Front. Bioeng Biotechnol. 7.
- Wille, J., Coenye, T. (2020). Biofilm dispersion: The key to biofilm eradication or opening pandora’s box? Biofilm 2, 100027.
- Yassein AS, Hassan MM, Elamary RB. Prevalence of lipase producer Aspergillus niger in nuts and anti-biofilm efficacy of its crude lipase against some human pathogenic bacteria. Sci Rep. 2021;11(1):7981. Published 2021 Apr 12.
- Clark DP, Pazdernik NJ, Chapter 11-Protein Engineering, Biotechnology, Second Ed., Academic Cell (2016), pp. 365 — 392.
- Инструкция по медицинскому применению лекарственного препарата Вобэнзим ЛП-№(002667)-(РГ-RU) от 30.06.2023
- Тец Г. В., Артеменко Н. К., Заславская Н. В. и соавт. Влияние экзогенных протеолитических ферментов на передачу плазмидных генов в смешанных бактериальных биоплёнках // Антибиотики и химиотерапия. — 2009. — Т. 54. — № 9–10. — С. 3–5.
- Устюжанин А. В., Чистякова Г. Н., Ремизова И. И. Изучение влияния ферментного препарата Вобэнзим на процесс формирования биоплёнок штаммов бактерий. Антибиотики и химиотер. 2024; 69 (1–2): 10–14.
Дизайн исследования влияния ферментного
препарата Вобэнзим на процесс формирования
биопленок штаммов бактерий: [30]
- 20 штаммов, обладающих повышенной способностью к плёнкообразованию: Escherichia coli — 16, Klebsiella pneumoniae — 1, Enterococcus faecalis — 2 и Enterobacter aerogenes — 1.
- 17 штаммов получены из отделяемого цервикального канала, 1 выделен из последа и 2 изолированы при посеве отделяемого слизистой зева новорожденного.
- Определяли к антибактериальным препаратам: ампициллин, амоксициллин + клавулановая кислота, цефотаксим, цефтазидим, цефепим, эртапенем, меропенем, амикацин, гентамицин, ципрофлоксацин, тайгециклин, фосфомицин, нитрофурантоин, триметоприм + сульфаметоксазол.
- Препарат Вобэнзим, содержащий трипсин, панкреатин, рутозида тригидрат, химотрипсин, бромелаин, липазу, амилазу, папаин.
- Антибиотики (ампициллин и амикацин) в комбинации с препаратом Вобэнзим.
- Микроорганизм, чувствительный к указанным антибиотикам, — E. coli.